Регенерация является защитной реакцией печени в ответ на её повреждение и определяется как комплекс жестко регулируемых физиологических процессов пролиферации гепатоцитов и непаренхиматозных клеток, приводящих к восстановлению нарушенной функции органа после его повреждения. Изменение баланса между пролиферацией печеночных клеток и их гибелью может лежать в основе формирования цирроза печени и гепатоцеллюлярной карциномы(ГЦК). В последние десятилетия активно ведётся поиск универсальных маркёров пролиферативной активности гепатоцитов. Одним из наиболее достоверных маркеров на сегодняшний день признан белок Ki-67, являющийся ядерным белковым комплексом с молекулярной массой 345-395 кДа [1]. Реакция с моноклональными антителами к Ki-67 позволяет определить количество клеток, подвергшихся делению, поскольку белок экспрессируется только в ядрах пролиферирующих клеток и выявляется в G1 (в конце фазы), G2, S и M-фазах клеточного цикла с максимальной экспрессией в фазах G2 и M [1]. К настоящему моменту в печати опубликовано большое количество работ, посвящённых выявлению Ki-67 при различных видах опухолей. Имеющиеся исследования с применением Ki-67 для оценки состояния печени у больных вирусными гепатитами пока в недостаточной степени характеризуют особенности регенерации органа в зависимости от этиологии и стадии процесса (цирроз печени, предцирротическая стадия (фиброз 3), ГЦК).
В связи с чем целью проведённого исследования было сравнение регенераторной способности печени (по оценке экспрессии Ki-67 в гепатоцитах) у больных в цирротической стадии хронических вирусных гепатитов различной этиологии (В, С, В + С), больных хроническим вирусным гепатитом без признаков цирроза и больных ГЦК.
Материалы и методы исследования
В исследование включены 35 больных с подтверждённой посмертно (морфологически) цирротической стадией хронического вирусного гепатита, умерших в клинической инфекционной больнице №30 им. С.П.Боткина в 2004-2007 гг.
Клинические методы исследования включали анализ истории болезни с целью регистрации пола, возраста на момент включения больного в исследование (лет), наличия систематического употребления алкоголя в анамнезе. Гистологическую активность гепатита (индекс гистологической активности - ИГА) и стадию заболевания оценивали по методике, предложенной R.G. Knodell и соавт.[9]. Этиологическую принадлежность вирусного гепатита определяли прижизненным выделением специфических маркёров вирусов гепатитов В и С (HBsAg, HBcorAb, HCVAb) из сыворотки крови методом твёрдофазного иммуноферментного анализа.
В качестве групп сравнения использовали биоптаты ткани печени больных хроническим гепатитом В (ХГВ) (n = 5) и С (ХГС) (n = 5) с высокой гистологической активностью (ИГА 13-18), с признаками прогрессирующего фиброза (F3), а также аутоптаты участков опухолевой ткани больных, умерших от ГЦК, развившейся на фоне цирротической стадии ХГB (n = 5) и ХГС (n = 5). В качестве контрольной группы использовали аутоптаты печени 5 человек, умерших от соматических заболеваний без клинико-биохимических и морфологических признаков поражений печени.
Иммуногистохимические исследования выполняли в срезах залитой в парафин ткани печени, с использованием моноклональных мышиных антител к Ki-67 (клон ММ1) в разведении 1/100 (NovocastraLab, UK) и системы детекции NovoLinkPolymerDetectionSystemDAB (NovocastraLab., UK). Гепатоциты, экспрессирующие Ki-67, имели специфическую коричневую окраску ядер. Учет результатов осуществляли путем определения индекса пролиферативной активности гепатоцитов (отношения Ki-67 - позитивных гепатоцитов ко всем гепатоцитам) в 6 полях зрения: по три поля из перипортальных и по 3 поля из центролобулярных отделов печеночных долек при увеличении х400.
Обработку первичных данных проводили с использованием программы SPSS 14.0. Характеристики выборок представлены в виде медианы (минимального значения/максимального значения). Для анализа качественных переменных использовали χ2-критерий Пирсона. Проверку закона распределения, при необходимости анализа количественных переменных, проводили при помощи теста Колмогорова-Смирнова, при необходимости с поправкой Лиллефорса, а также теста Шапиро-Уилка. В последующем в случае сравнения трёх групп, в связи с тем, что хотя бы одна из выборок имела отличное от нормального распределение, применяли критерий Краскела-Уоллиса. Для попарного сравнения выборок использовали U тест Манна-Уитни (точное 2-стороннее значение). Для определения силы связи между употреблением алкоголя и возрастом умерших использовали двухсторонний ранговый корреляционный анализ Спирмена.Критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий и влияний) принимали равным 0,05.
Результаты исследования и их обсуждение
В обследованной группе умерших с циррозом печени вирусной этиологии (n = 35) 83% были моложе 60 лет, медиана возраста составила 49,0 лет (минимум - 26 лет, максимум 72 года), мужчин было16 (46 %) человек, женщин - 19 (54 %). Хронический гепатит В выявлен у 17 больных (48%), ХГС - у 10 больных (29%), ХГВ + ХГС - у 8 больных (23 %). Подгруппы больных с циррозами печени на фоне ХГВ, ХГС и ХГВ+ХГС достоверно не отличались между собой по полу (мужчин/женщин 6/11, 6/4 и 6/2, соответственно, χ2 = 3,64, р = 0,162) и возрасту (49(35/65), 47(26/68), 36(30/72) лет соответственно р = 0,167). Большая часть включённых в исследование систематически употребляли алкоголь (71,4%), употребление алкоголя обратно коррелировало с возрастом умерших пациентов (r = -0,361, p = 0,033).
Различные нозологические формы вирусного гепатита - ХГВ, ХГС и ХГВ+ХГС с исходом в цирроз при одинаковой гистологической активности гепатита (ИГА 13-18) характеризовались разной степенью пролиферативной активности гепатоцитов (рис. 1). Медиана показателя пролиферативной активности гепатоцитов у больных циррозом печени в исходе ХГВ (ХГВ-ЦП) составила 1,4 (0,4/12,46), в исходе ХГС (ХГС-ЦП) - 11,98 (1,6/19,7) %, при микст-циррозе печени (ХГВ+С-ЦП) - 3,0(0,3/18,97)%. При попарном сравнении групп с ХГВ-ЦП и ХГС-ЦП отмечена статистически значимая более высокая пролиферативная активность в последней группе (p = 0,016). Медиана индекса пролиферативной активности у пациентов с цирротической стадией микст-гепатитов статистически значимо не отличалось от пациентов ХГВ-ЦП (р = 0,868) и ХГС-ЦП (р = 0,279).
Сравнение индекса пролиферативной активности гепатоцитов у больных ХГВ с высокой гистологической активностью гепатита (ИГА 13-18) и признаками прогрессирующего фиброза (F3), составившего 9,7(3,2/10,8) %, с индексом пролиферативной активности гепатоцитов при ХГВ-ЦП, составившего 1,4 (0,4/12,46) %, показало достоверно более высокий уровень этого показателя у больных ХГВ (р = 0,033). Напротив, у больных ХГС с высокой гистологической активностью гепатита (ИГА 13-18) и признаками прогрессирующего фиброза (F3) индекс пролиферативной активности составил лишь 1,9 (0,8/4,1) %, что значимо ниже, чем при ХГС-ЦП (р = 0,048).Следует отметить, что индекс пролиферативной активности больных ХГВ, не достигших цирроза печени был достоверно выше, чем у больных ХГС, не достигших цирроза печени (р = 0,016) при одинаково высокой гистологической активности гепатита (ИГА 13-18) в обеих группах.
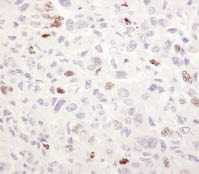
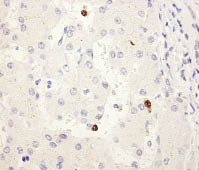
А Б
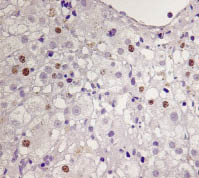
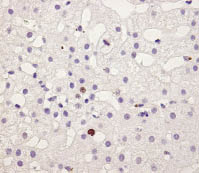
В Г
Рис. 1. Экспрессия Ki-67 в опухолевой ткани ГЦК на фоне ХГС (А), в ткани печени
при ХГВ-ЦП (Б), ХГВ без признаков цирроза (В), в контрольном образце (Г). Иммуногистохимическая реакция, DAB, х400
Индекс пролиферативной активности клеток опухолевой ткани больных ГЦК, развившейся на фоне ХГB-ЦП, составил 12,7 (10,0/18,0) % и был достоверно выше, чем в ткани печени у больных ХГВ (р = 0,032) и ХГВ-ЦП (p = 0,002). Пролиферативная активность клеток опухолевой ткани больных ГЦК, развившейся на фоне цирротической стадии ХГС, составила 46,0 (39,0/56,0) % и была значимо выше, чем при ГЦК, развившейся на фоне цирротической стадии ХГВ (р = 0,009), а также достоверно выше, чем у больных ХГС (р = 0,032) и больных, умерших от ХГС-ЦП (p = 0,003).
Показатель пролиферативной активности при различных исходах хронического гепатита представлен
на рис. 2.

Рис. 2. Пролиферативная активность (по экспрессии Ki-67) гепатоцитов
и клеток опухоли у больных хроническими гепатитами В и С при различных исходах патологического процесса (n = 47)
При сравнении пролиферативной активности печёночных клеток больных цирротической стадией ХВГ, систематически употреблявших алкоголь, 3,9 (0,3/19,7) % и пациентов без систематического употребления алкоголя в анамнезе 1,5 (0,3/18,27) % статистически достоверных различий не получено (p = 0,129).
Во всех исследованных группах по сравнению с контрольной группой больных, умерших от соматических заболеваний, в которой медиана индекса пролиферативной активности составила 1,4 (0/2,8) %, наблюдалась более высокая пролиферативная активность гепатоцитов, но статистической достоверности различия достигли только с группами больных ГЦК на фоне ХГВ (р = 0,008), ГЦК на фоне ХГС (р = 0,008), ХГВ (р = 0,008) и ХГС-ЦП (р = 0,03).
Результаты исследования и их обсуждение
Полученные нами на ограниченной выборке (n = 35) данные свидетельствуют, что естественная (при отсутствии противовирусной терапии) прогрессия хронических гепатитов В,С и В+С до стадии цирротической трансформации с наступлением летального исхода пришлась на трудоспособный возраст (83 % умерших моложе 60 лет), медиана - 49 лет. При этом медиана возраста умерших от ХГВ + С-ЦП (36 лет) была на 11 и 13 лет меньше умерших от ХГВ-ЦП и ХГС-ЦП соответственно. Полученные результаты не противоречат проведённым ранее исследованиям, демонстрирующим ассоциацию развития цирроза с микстинфицированием гепатотропными вирусами [2, 12, 5, 18, 4], и могут свидетельствовать о более быстром прогрессировании патологических процессов в печени у данной группы пациентов. Вероятно, на скорость прогрессирования процесса негативно повлияло и злоупотребление алкоголем, имевшееся в анамнезе у большинства умерших, и обратно коррелировавшее с возрастом. В многочисленных, выполненных ранее исследованиях, употребление алкоголя ассоциировалось как с прогрессированием гепатита, так и с наступлением летального исхода [15, 4, 11, 16], в том числе, возможно, и за счёт установленного недавно in vitro эффекта усиления репликативной активности вируса этанолом [13].
В данной выборке не было выявлено явного преобладания мужчин или женщин среди умерших от цирроза печени (46 и 54 % соответственно), не было гендерных различий и в подгруппах по нозологии цирроза. Литературные сведения на эту тему противоречивы. Так, J.-F. Cadraneletal [5], изучая факторы риска развития цирроза у 1166 HBsAg позитивных пациентов различных госпиталей Франции, значимой связи с полом не выявили, однако, при преобладании мужчин в целом среди инфицированных, женщин в группе пациентов с циррозом было больше. Сходные результаты были получены B.K. Parketal [14] и J.I. Weissbergetal [17]. T. Poynardetal, в 2001 г. [15] у пациентов с хроническим гепатитом С выявили ассоциацию прогрессии заболевания до цирротической стадии с мужским полом. Наши данные свидетельствуют о практически равном распределении умерших от цирроза печени по половому признаку: при анализе медицинской документации всех умерших от хронических гепатитов моновирусной этиологии в цирротической стадии в Клинической инфекционной больнице им С.П. Боткина г. Санкт-Петербурга за 2006-2009 гг., показано, что 52 % умерших были мужского, а 48% - женского пола (исследование не представлено), что не противоречит результатам, полученным в представляемом исследовании.
В условиях физиологической нормы гепатоциты постоянно подвергаются обновлению посредством апоптоза с последующей элиминацией. Восстановление популяции гепатоцитов характеризуется повышением их пролиферативной активности и восстановлением внутриорганного гомеостаза. В условиях патологии уровень пролиферативной активности гепатоцитов при сохраненных механизмах регуляции теоретически должен соответствовать тяжести повреждения.Несоответствие уровня пролиферации гепатоцитов тяжести повреждения может свидетельствовать о нарушении регуляторных механизмов, что, с одной стороны, может приводить к нарушению функции органа, а с другой стороны, - к неконтролируемому клеточному росту, лежащему в основе развития гепатоцеллюлярной карциномы. Пролиферативная активность гепатоцитов при ХГВ, как было показано в предшествующих исследованиях [3], имеет достоверную тенденцию к возрастанию по мере увеличения повреждения в виде нарастания цитолиза и возрастания гистологической активности гепатита, достигая максимума на высоте повреждения (индекс пролиферативной активности коррелирует с ИГА). Цирротическая трансформация печени с декомпенсацией характеризуется крайне низкой пролиферативной активностью гепатоцитов. Максимальные значения индекса пролиферативной активности регистрируются в ткани ГЦК, развившейся на фоне цирротической стадии ХГВ [3]. Данные, полученные в обсуждаемой выборке, подтверждают такие закономерности, отражая относительную сохранность регенераторного потенциала печени на этапе хронического вирусного гепатита В в ответ на тяжелое повреждение. Снижение регенераторной способности печени при ХГВ-ЦП отражает нарушение регуляторных механизмов и при сохраняющемся высоком уровне повреждения (ИГА 13-18 баллов) ведёт к развитию печеночной недостаточности.
Обратные тенденции мы наблюдали при ХГС и ХГС-ЦП, когда выраженное повреждение печеночной ткани (ИГА 13-18 баллов) у больных ХГС вызывало низкую пролиферацию гепатоцитов, достоверно возрастающую на этапе ХГС-ЦП. Индекс пролиферативной активности гепатоцитов у больных ХГВ-ЦП был достоверно ниже, чем у больных ХГС-ЦП. Подобная разнонаправленность процессов требует детального изучения. Возможно, именно разница в характере пролиферативной активности при гепатитах В и С лежит в основе разной частоты хронизации, влияет на темп прогрессирования и частоту развития ГЦК.Следует, однако, отметить, что в более раннем исследовании, включавшем 40 больных ХГВ-ЦП и 17 больных ХГС-ЦП, не было выявлено различий в экспрессии Ki-67 в зависимости от этиологии цирроза [10], а пролиферативная активность увеличивалась с наступлением цирроза как при гепатите В, так и при гепатите С.
Согласно полученным нами данным у больных ГЦК как на фоне цирроза печени, ассоциированного как с вирусом гепатита С, так и с вирусом гепатита В, индекс пролиферативной активности опухолевой тканирезко возрастает, что вполне согласуется с данными литературы [8, 10]. Следует отметить, что в более «детализированном» морфологическом исследовании, выполненном J. Koskinas в 2005 г., показано, что в очагах опухолевой ткани экспрессия Ki-67 выше, чем в окружающей ткани печени, и индекс возрастает с увеличением степени злокачественности опухоли. Более того даже неопухолевая ткань у пациентов с циррозом вирусной этиологии и ГЦК экспрессировала достоверно больше Ki-67 (среднее - 10,18%), чем ткань печени больных циррозом без ГЦК (среднее - 5,5 %) [10].
Статистически значимых отличий между пролиферативной активностью гепатоцитов у пациентов c циррозом печени, систематически употребляющих алкоголь (медиана - 3,9 %) и пациентов без систематического употребления алкоголя (медиана - 1,5 %) мы не выявили. Однако в исcледовании регенераторной способности цирротически трансформированной печени, выполненном N. Horiguchietal. в 2007 г. [7], установлено, что регенерация печени подавлена у пациентов, страдающих алкоголизмом. Аналогичные данные получены и в группах пациентов, не достигших цирротической стадии [6].
В контрольной группе больных, умерших от соматической патологии, выявлен низкий уровень пролиферативной активности (медиана - 1,4 %, минимум - 0, максимум 2,8 %), сходный с уровнем, наблюдаемым рядом других исследователей [8, 7].
Заключение. Пролиферация гепатоцитов, уровень которой отражает регенераторный потенциал печени,зависит от этиологии хронического вирусного гепатита (В или С) и стадии патологического процесса (хронический гепатит, цирроз печени или ГЦК). Различные показатели пролиферативной активности гепатоцитов у больных хроническим гепатитом и хроническим гепатитом с исходом в цирроз при различной этиологии процесса (вирус гепатита В или С)и одинаковом высоком уровне повреждения (ИГА 13-18 аллов) свидетельствуют о разных механизмах патогенеза хронической инфекции, вызванной вирусами гепатитов В и С, и требуют проведения дальнейших исследований.
Список литературы
- Диагностическая иммуногистохимия опухолей / под. ред. Д.Ф. Глузмана. - К.: Морион, 2003. - 193 с.
- Непомнящих Д.Л., Айдагулова С.В., Непомнящих Г.И. Биопсия печени: патоморфогенез хронического гепатита и цирроза. - М.: Изд-во РАМН, 2006. - 368 с.
- Шапиро И.Я., Карев В.Е.. Гепатоцеллюлярная карцинома, ассоциированная с НВV. Особенности эпидемиологии, клиники и морфологии. Клеточно-молекулярные аспекты патогенеза и диагностики / под. ред. А.В. Шаброва. - М.: Триада Лтд., 2007. - 167 с.
- Amin J, Law MG, Bartlett M, Kaldor JM, Dore GJ. Causes of death after diagnosis of hepatitis B or hepatitis C infection: a large community-based linkage study. Lancet. - 2006. - 368. - Р. 938-945.
- Cadranel J.-F., Lahmek P., Causse X. et al. Epidemiology of chronic hepatitis B infection in France: risk factors for significant fibrosis - results of a nationwide survey // Alimentary Pharmacology & Therapeutics. - 2007. - Vol. 26, № 4. - P. 565-576.
- Farinati F., Cardin R., D,Errico A. et al. Hepatocyte proliferative activity in chronic liver damage as assessed by the monoclonal antibody MIB1 Ki-67 in archival material: the role of etiology, disease activity, iron, and lipid peroxidation // Hepatology. - 1996. - Vol. 23. - P. 1468-1475.
- Horiguchi N., Ishac E.J.N., Gao B. Liver regeneration is suppressed in alcoholic cirrhosis: Correlation with decreased STAT3 activation // Alcohol. - 2007. - Vol. 41(4). - P. 271-280.
- Kaita K.D.E., Pettigrew N., Minuk G.Y. Hepatic regeneration in humans with various liver disease as assessed by Ki-67 staining of formalin-fixed paraffin embedded liver tissue // Liver. - 1997. - Vol. 17, №1. - P. 13-16.
- Knodell R.G., Ishak K.G., Black W.C., et al. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis // Hepatology. - 1981. - Vol. 1, № 5. - P. 431-435.
- Koskinas J., Petraki K., Kavantzas N. et al. Hepatic expression of the proliferative marker Ki-67 and p53 protein in HBV or HCV cirrhosis in relation to dysplastic liver cell changes and hepatocellular carcinoma // Viral Hepatitis. - 2005. - №12(6). - Р. 635-641.
- Marcellin P, Pequignot F, Delarocque-Astagneau E et al. Mortality related to chronic hepatitis B and chronic hepatitis C in France: evidence for the role of HIV coinfection and alcohol consumption // Hepatol. - 2008. - №48. - Р. 200-207.
- Mathurin P., Thibault V., Kadidja K. et al.Replication status and histological features of patients with triple (B,C,D) and dual (B,C) hepatic infection // Viral Hepatitis. - 2000. - Vol. 7. - P. 15-22.
- McCartney E.M., Semendric L., Helbig K.J. et al. Alcohol metabolism increases the replication of hepatitis C virus and attenuates the antiviral action of interferon // J. of Infect Dis. . - 2008. - Vol. 198(12). - P. 1766-1775.
- Park B.K., Park Y.N., Ahn S.H. et al. Long-term outcome of chronic hepatitis B based on histological grade and stage // Gastroenterol and Hepatol. - 2007. - Vol. 22, № 3. - P. 383-388.
- Poynard T., Ratziu V., Charlotte F. et al. Rates and risk factors of liver fibrosis progression in patients with chronic hepatitis C // Hepatology. - 2001. - Vol. 34(5). - P. 730-739.
- Prasad L., Spicher V.M., Negro F., Rickenbach M., Zwahlen M. Little evidence that hepatitis C virus leads to a higher risk of mortality in the absence of cirrhosis and excess alcohol intake: the Swiss hepatitis C cohort study //Viral Hepatitis. - 2009. - Vol. 16(9). - P. 644-649.
- Weissberg J.I., Andres L.L., Smith C.I. et al. Survival in chronic hepatitis B: an analisys of 379 patients // Ann. Intern. Med. - 1984. - Vol. 101, № 1. - P. 613-616.
- Zarski J.P., Bohn B., Bastie A. et al. Characteristics of patients with dual infection by hepatitis B and C viruses // Hepatology. - 1998. - Vol. 28, № 1. - P. 27-33.
Рецензенты:
Горячева Л.Г., д.м.н., ведущий научный сотрудник, руководитель отдела вирусных гепатитов и заболеваний печени ФГУ НИИ детских инфекций ФМБА России, Санкт-Петербург;
Романцов М.Г., д.м.н., профессор кафедры инфекционных болезней СПбГМА им. И.И. Мечникова, руководитель отдела координации медико-биологических исследований научно-технологической фармацевтической фирмы «ПОЛИСАН», г. Санкт-Петербург.



